Como esporos podem impactar em sistemas de limpeza em circuito fechado (CIP – Clean in place).
O processo de CIP é amplamente empregado em indústrias para garantir a limpeza e a sanitização dos equipamentos que compõem a linha de produção. No entanto, relatos da existência de esporos microbianos resistentes às condições térmicas e químicas utilizadas durante o CIP estão cada vez mais frequentes.
O que é CIP e qual o seu papel nas indústrias?
Atualmente, é de grande preocupação por parte das indústrias (químicas, farmacêuticas, cosméticas e sobretudo alimentícias) a elaboração e manutenção adequada de processos de limpeza e sanitização, a fim de evitar contaminações microbianas e garantir a qualidade dos produtos finais e a segurança dos consumidores.
Dentre os métodos comumente empregados para a higienização em linhas de produção, destaca-se o sistema CIP (do ingês cleaning in place). Essa abordagem baseia-se no uso de uma mistura de compostos químicos, calor e água, em um sistema de circulação e recirculação em circuito fechado, para efetuar a limpeza de máquinas, tubulações e tanques em indústrias.
Em outras palavras, consiste no emprego controlado e interconectado de agentes químicos, mecânicos, de temperatura e de tempo, para a eliminação de sujidades e de microrganismos. Suas principais vantagens são a automatização, a facilidade de implementação na linha de produção, a não necessidade de remoção ou desmonte dos componentes do sistema e a redução de gastos hídricos e energéticos.
No entanto, apesar da ampla disseminação e adoção desse sistema nas indústrias e da sua notável confiabilidade, diversos relatos descrevem a existência de esporos bacterianos resistentes às condições térmicas e químicas empregadas no CIP, assim gerando problemas de contaminação e atentando para os perigos destes esporos e para a necessidade de um controle mais rigoroso do sistema.
Porque esporos são termorresistentes?
Apesar do emprego de temperaturas elevadas durante o processo de higienização CIP, esporos bacterianos podem sobreviver. A resistência à condições adversas é uma característica intrínseca aos mesmos, que são formados quando as bactérias encontram-se em situações inóspitas de sobrevivência. No que diz respeito à temperatura, estima-se que os esporos suportem de 30 a 40ºC a mais do que suas respetivas células bacterianas.
Esporos microbianos cujo ótimo de crescimento se dá em temperaturas elevadas (entre 41 e 122 ºC) são denominados termófilos. Embora o mecanismo para a sua adaptabilidade não esteja totalmente elucidado, a principal hipótese é de que ele se dá pela sinergia de diversos fatores. O primeiro deles está relacionado ao conteúdo de água presente no núcleo do esporo, que é muito menor do que o das células em si. Quanto menor o conteúdo, maior a resistência ao calor úmido. Ainda, os esporos termófilos possuem macromoléculas, sobretudo proteínas, com alta termoestabilidade.
Por fim, cerca de 5 a 15% do peso seco dos esporos é constituído por um composto químico denominado ácido dipicolínico (DPA), que implica em resistência térmica. O DPA forma um complexo com íons de cálcio dentro do núcleo do endósporo e liga a moléculas livres de água, causando a desidratação do esporo e consequentemente aumentando a resistência ao calor. O complexo de cálcio-DPA também é capaz de proteger ácidos nucléicos e aumentar a sua estabilidade, evitando assim à morte dos esporos por dano ao DNA.
Dentre os gêneros bacterianos conhecidamente capazes de produzir esporos termófilos, destacam-se os gêneros Bacillus e Clostridium. Estes são comumente encontrados associados a superfícies de equipamentos em vários ambientes industriais, e são de grande preocupação por parte das indústrias alimentícias, dados os riscos que podem oferecer à segurança e à saúde humana.
Por que esporos resistem a sanitizantes?
Além de resistirem ao calor, os esporos bacterianos também podem resistir aos químicos utilizados no processo de sanitização do CIP, o qual visa diminuir a carga microbiana a um nível seguro.
Dentre os principais sanitizantes utilizados nesse processo, destacam-se o hipoclorito de sódio, o ácido peroxiacético e os iodóforos, além dos agentes químicos ácidos e básicos empregados no processo de limpeza. Estes produtos utilizam mecanismos de dano ao DNA ou as camadas e membranas que protegem o interior do esporo. Entretanto, a resistência dos esporos a essas condições se deve a um conjunto de características intrínsecas.
Um dos fatores envolvidos é a presença da capa proteica que protege o esporo, na qual já foram identificadas enzimas que podem estar envolvidas na defesa contra agentes oxidantes. Além disso, a membrana interna é altamente impermeável e impede que muitas moléculas prejudiciais tenham acesso ao cerne do esporo.
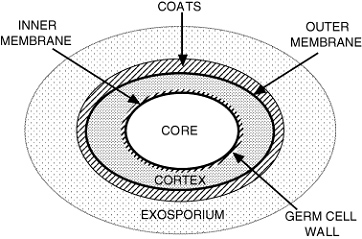
Figura 1: Esquema da estrutura do esporo microbiano. (Fonte: Setlow, 2006)
Outra peculiaridade destas estruturas são proteínas sintetizadas unicamente durante a esporulação, as SASP (Small Acid-Soluble Spore Proteins). Estas proteínas se ligam ao DNA, diminuindo sua reatividade com outros agentes químicos, inclusive sanitizantes. Ainda, outros mecanismos de reparo de DNA e macromoléculas atuam no processo de germinação e superação de dormência, permitindo a recuperação e viabilidade da bactéria.
Como esporos podem dificultar o processo de higienização em circuito fechado?
Devido à alta resistência às condições de limpeza do CIP, alguns esporos podem persistir nos dutos e tanques das indústrias. Isso porque além de suas características que lhes permite sobreviver ao ambiente desfavorável, alguns esporos também possuem a capacidade de se aderir a várias superfícies, inclusive o aço inoxidável das tubulações.
Essa propriedade, presente em algumas espécies de Bacillus, se deve principalmente a hidrofobicidade do esporo, que interage com superfícies como as do aço inoxidável dos equipamentos industriais. Além disso, mecanismos de ancoragem através de apêndices presentes no exósporo fortalecem a capacidade de aderência.
Devido a isso, a remoção dos esporos e outras sujidades depende fortemente da geometria das tubulações – dobras, estreitamentos – que impacta na intensidade do fluxo dos fluidos utilizados no CIP. Contudo, é notável que após o processo de limpeza, alguns esporos podem permanecer nos equipamentos, atentando para o problema da readesão dos mesmos. Esta ocorre principalmente em áreas de recirculação e desaceleração dos fluidos de limpeza, demonstrando o importante papel dos padrões de fluxo dos agentes químicos utilizados.
Apesar disso, alguns compostos alcalinos empregados no CIP são capazes de danificar estruturas de proteção do esporo, possivelmente impedindo-o de germinar mesmo com condições ambientais favoráveis na indústria. Todavia, é fundamental que se considere novas estratégias de limpeza afim de eliminar chances de contaminação por estes microrganismos.
Em suma, o sistema CIP utiliza variados produtos químicos, água e diferentes temperaturas para a limpeza e sanitização de máquinas e tubulações nos ambientes industriais. Sua vantagem é que os equipamentos não precisam ser desmontados, uma vez que tudo ocorre em um sistema de circulação fechada.
Devido a sua praticidade, baixo custo e segurança operacional, esta metodologia vem sendo amplamente adotada, demonstrando grande eficiência. Entretanto, estruturas resistentes às condições do CIP, como esporos bacterianos, têm se tornado um grande desafio.
Daí a importância de atentar para a avaliação e monitoramento das CIP, utilizando metodologias que consigam mensurar a presença destes esporos após as etapas de higienização. Na mesma linha, é fundamental elaborar estratégias que contribuam para a eliminação destes microrganismos, evitando contaminações e fornecendo produtos seguros à população.
Referências
BLEL, W. et al. Effect of flow arrangement on the removal of Bacillus spores from stainless steel equipment surfaces during a Cleaning In Place procedure. 2007. v. 62, p. 3798–3808
CHRISTINE, B. Re-adhesion of bacterial spores during CIP. 2018. p. 1–18.
CORTEZZO, D. E.; SETLOW, B.; SETLOW, P. Treatment with oxidizing agents damages the inner membrane of spores of Bacillus subtilis and sensitizes spores to subsequent stress. 2004. p. 838–852
CORTEZZO, D. E.; SETLOW, P. Analysis of factors that influence the sensitivity of spores of Bacillus subtilis to DNA damaging chemicals. 2005. p. 606–617.
DONNELL, G. M. C. Antiseptics and Disinfectants: Activity, Action, and Resistance. 1999. v. 12, n. 1, p. 147–179.
FAILLE, C. et al. Morphology and physico-chemical properties of Bacillus spores surrounded or not with an exosporium Consequences on their ability to adhere to stainless steel. 2010. v. 143, n. 3, p. 125–135.
HENRIKSSON, A. Adhesion of bacillus spores in relation to hydrophobicity. 1990. n. Atcc 12980.
JULLIEN, C. Identification of surface characteristics relevant to the hygienic status of stainless steel for the food industry. 2002. v. 56, p. 77–87.
KUSUMANINGRUM, H. D. et al. Survival of foodborne pathogens on stainless steel surfaces and cross-contamination to foods. 2003. v. 85, p. 227–236.
LELIE, C. Modelling of Cleaning Kinetics of Pipes Soiled by Bacillus Spores Assuming a Process Combining Removal. 2002. v. 80, n. December.
NICHOLSON, W. L. et al. Resistance of Bacillus Endospores to Extreme Terrestrial and Extraterrestrial Environments. 2000. v. 64, n. 3, p. 548–572.
PENG, J.; TSAI, W.; CHOU, C. Surface characteristics of Bacillus cereus and its adhesion to stainless steel. 2001.
RIESENMAN, P. J.; NICHOLSON, W. L. Role of the Spore Coat Layers in Bacillus subtilis Spore Resistance to Hydrogen Peroxide, Artificial UV-C, UV-B, and Solar UV Radiation. 2000. v. 66, n. 2, p. 620–626.
SCHMIDT, R. H. Basic Elements of Equipment Cleaning and Sanitizing in Food Processing and Handling Operations. 2009.
SETLOW, P. Mechanisms for the prevention of damage to DNA in spores in bacillus species. 1995. p. 29–54
SETLOW, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. 2006. v. 101, n. June 2005, p. 514–525.
YOUNG, S. B.; SETLOW, P. Mechanisms of killing of Bacillus subtilis spores by hypochlorite and chlorine dioxide. 2003. p. 54–67.

